В интернете кто-то неправ! Научные исследования спорных вопросов - Ася Казанцева Страница 13
В интернете кто-то неправ! Научные исследования спорных вопросов - Ася Казанцева читать онлайн бесплатно
Ознакомительный фрагмент
Помощник именно так и называется – хелпер, от английского help. Если совсем точно, “Т-хелпер второго типа”. Эта клетка иммунной системы принимает решение о том, должен ли B-лимфоцит запускать полноценные военные действия.
Ответ будет положительным, если Т-хелпер как раз недавно познакомился с точно таким же патогеном (а значит, эти встречи – не случайность, а закономерность). Сам Т-хелпер за микробами не гоняется, ему помогает третий участник истории: дендритная клетка, которая ловит врагов и притаскивает их в лимфатический узел. Там она выставляет молекулы патогенов на своей поверхности и демонстрирует наивным Т-хелперам (наивность – официальный термин: клетка еще не специализирована). Когда наконец найдется наивный Т-хелпер, способный этого врага опознать (у них там тоже сложный процесс формирования разнообразных рецепторов), то он может превратиться в Т-хелпер второго типа, способный стимулировать работу B-лимфоцита и синтез антител.
Когда Т-хелпер второго типа, способный распознавать те антигены, которые ему показала дендритная клетка, встречается с В-лимфоцитом, который тоже распознал аналогичные антигены, можно наконец-то запускать иммунный ответ. Под влиянием сигналов от Т-хелпера подходящий В-лимфоцит начинает интенсивно размножаться. При этом в новых клетках не просто воспроизводятся антитела, способные связывать вражеские антигены: запускается мутационный процесс, и у всех потомков антитела получаются немножко разными. Большинство из них будет связываться с антигеном хуже, чем антитела клетки-родоначальника, но некоторые, наоборот, начнут подходить гораздо лучше. И наконец, когда появятся В-лимфоциты с антителами, идеально подходящими к вражескому антигену, они дадут начало двум новым линиям клеток: плазматическим клеткам и B-клеткам памяти.
B-клетки памяти на войну с микробами не пойдут, зато сохранят варианты генов, идеально подходящие для строительства антител против данного возбудителя, чтобы при новом контакте с ним организму не пришлось бы заново изобретать велосипед. А вот плазматические клетки начнут интенсивно продуцировать антитела и выделять их в окружающее пространство. Эти антитела будут связываться с врагами, облеплять их со всех сторон, мешать им проникать в наши клетки, будут привлекать пристальное внимание других иммунных клеток (например, макрофагов, которые врага просто съедят), активировать систему комплемента (комплекс белков плазмы крови, которые будут разрушать врага) и так далее. В общем, если в крови есть много антител против патогена, то у него нет никаких шансов. По крайней мере, это верно для большинства болезней.
Для чего я все это рассказываю? Совершенно не обязательно, чтобы вы могли завтра пересказать, в каких отношениях находятся B-лимфоцит с T-лимфоцитом. Это знание пригодится при чтении второго такого же сложного куска про иммунную систему в главе про ВИЧ, но вот для восприятия всего остального текста книги в нем нет необходимости. Важнее другое. Я хочу подчеркнуть, что запуск иммунного ответа – это длинный, сложный и многоступенчатый процесс, для которого большое количество разных клеток должно оказаться в нужное время в нужном месте. Из этого вытекает важное неприятное следствие: на то, чтобы развернуть иммунную реакцию, требуется много времени. Пик выработки антител приходится на 8–10-е сутки с момента первого знакомства с антигеном. Этого времени многим бактериям и вирусам, увы, вполне может хватить для того, чтобы убить хозяина.
Совсем другое дело, если уже существует иммунологическая память. Организм в этой ситуации реагирует намного быстрее – процесс разворачивания боевых мощностей занимает всего 1–3 дня, да и концентрация антител при вторичном иммунном ответе в сотни раз выше. В этой ситуации человек либо вообще не заметит, что у него была потенциально смертельная болезнь, либо по крайней мере перенесет ее намного легче. Собственно, для этого и нужна вакцинация.
По легенде, открытие общего принципа вакцинации, как и многие другие великие открытия, было сделано благодаря разгильдяйству. В соответствии с описанием, которое приводится в чудесной книге Поля де Крюи “Охотники за микробами”, Луи Пастер заражал цыплят куриной холерой и искал способ ее лечения, но однажды ввел птицам просроченную, испорченную культуру. Они заболели, однако не умерли, а быстро поправились. Когда Пастер затем попытался использовать этих цыплят для последующих опытов, уже с хорошей культурой бактерий, выяснилось, что заразить их теперь не получается. Это позволило сформулировать идею, впоследствии подтвержденную для самых разных болезней: “Контакт с ослабленным возбудителем предохраняет от последующего тяжелого заболевания”.
Сегодня, когда мы понимаем, как все это работает [21], оказывается, что в некоторых случаях даже не требуется иметь дело с целым возбудителем: бывает достаточно отщипнуть от него кусочек и показать иммунной системе (как полицейской собаке дают понюхать предмет одежды пропавшего человека, чтобы она потом могла найти его самого). Например, в современной вакцине против гепатита B нет никаких возбудителей гепатита В – еще не хватало! – а есть только белок внешней оболочки вируса, HBsAg (hepatitis B surface antigen), синтезированный с помощью дрожжей. Вакцинация против дифтерии и столбняка формирует антитела не против самих бактерий, а против их токсинов, потому что убивают человека именно токсины. Если их обезвредить, то сами бактерии иммунная система спокойно ликвидирует без посторонней помощи. При этом вводят во время вакцинации не сам белок-токсин (он все-таки страшно ядовитый), а его инактивированную форму – анатоксин (разница приблизительно как между сырым и вареным яичным белком; на практике сходства достаточно для того, чтобы иммунная система могла запомнить важные аминокислотные последовательности и выработать к ним антитела, но вот активность токсина утрачена, и он не вредит клеткам нашего организма).
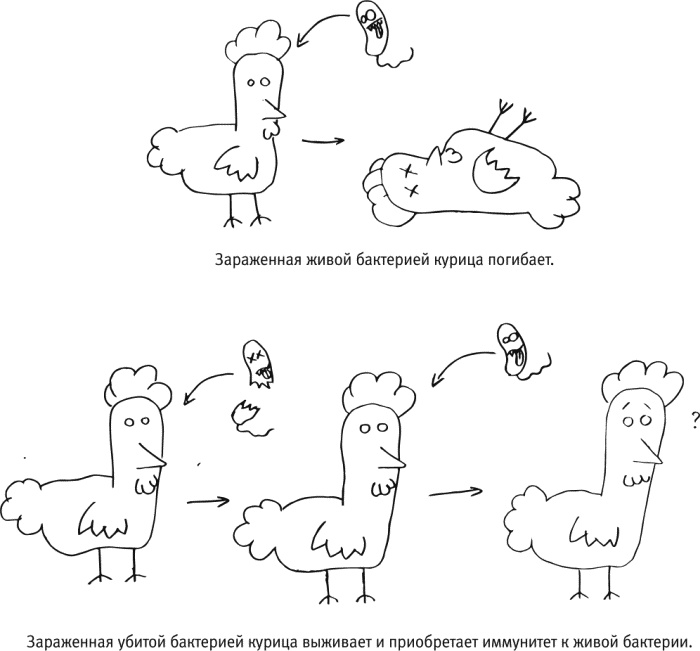
Такой способ вакцинации подходит, если вирус густо покрыт белками одного и того же типа (как в случае с гепатитом B) или если опасность во время заболевания представляет какой-то один конкретный белок (как в случае с дифтерией или столбняком). При профилактике многих других болезней надежнее было бы вырабатывать антитела не к одной-единственной молекуле, а сразу к широкому спектру белков, характерных для возбудителя, чтобы иммунная система атаковала его со всех сторон – в прямом смысле слова. Необязательно, чтобы возбудитель при этом был живым [17], – нужно, чтобы он был более или менее целым. Хотя у живых ослабленных возбудителей есть свои преимущества: после попадания в организм они успевают некоторое время там поразмножаться, благодаря чему привлекают особенно пристальное внимание иммунной системы (а значит, для надежного формирования иммунитета к болезни, как правило, требуется меньше ревакцинаций, чем при введении убитой вакцины или какого-нибудь отдельного белка). На практике оба типа вакцин – убитую и живую – можно комбинировать; именно так делают в последние годы при профилактике полиомиелита.
Жалоба
Напишите нам, и мы в срочном порядке примем меры.





Комментарии