Эпигенетика. Как современная биология переписывает наши представления о генетике, заболеваниях и наследственности - Несса Кэри Страница 58
Эпигенетика. Как современная биология переписывает наши представления о генетике, заболеваниях и наследственности - Несса Кэри читать онлайн бесплатно
Как мы уже говорили, С. elegans представляет собой очень удобную системную модель, потому что нам точно известно, как должны развиваться все его клетки. Временные рамки и последовательность различных стадий развития очень жестко отрегулированы. Одним из ключевых регуляторов является белок под названием LIN-14. Ген LIN-14 экспрессируется очень активно (продуцируя белок UN-14 в больших количествах) на самых ранних стадиях эмбрионального развития, но подвергается понижающей регуляции, когда из личиночной стадии 1 червь переходит в личиночную стадию 2. Если ген LIN-14 мутирует, нарушаются временные рамки прохождения различных стадий развития. Если белок LIN-14 продолжает вырабатываться слишком долго, червь начинает повторять ранние стадии развития. Если продукция белка UN-14 прекращается слишком рано, червь преждевременно переходит на более поздние личиночные стадии. В любом случае, его нормальное развитие становится невозможным.
В 1993 году две работавшие независимо друг от друга лаборатории продемонстрировали, как контролируется экспрессия LIN-14 [138] [139]. К всеобщему удивлению оказалось, что ключевым фактором этого процесса было связывание короткой нкРНК с молекулой мРНК LIN-14. Это показано на рисунке 10.3. Это пример посттранскрипционного сайленсинга (глушения) гена, при котором мРНК вырабатывается, но не может продуцировать белок. Это совершенно иной способ контроля экспрессии генов в отличие от того, каким пользуются длинные нкРНК.
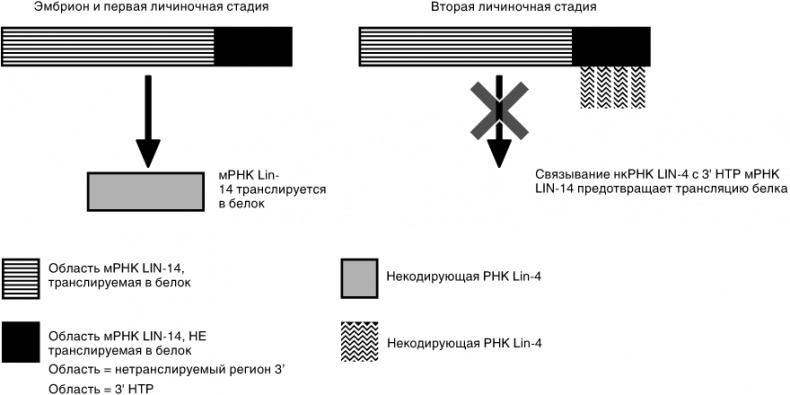
Рис. 10.3. Схематическое изображение того, как экспрессия микроРНК на определенных стадиях развития можетрадикально изменить экспрессию гена-мишени
Важность этой работы заключается в том, что она заложила фундамент для совершенно новой модели регуляции экспрессии генов. Короткие нкРНК, как нам теперь известно, являются механизмом, которым пользуются организмы всего растительного и животного мира для контроля экспрессии генов. Существуют разнообразные виды коротких нкРНК, но мы уделим внимание в основном микроРНК (миРНК).
В клетках млекопитающих идентифицировано, по меньшей мере, 1 000 различных миРНК. В длину миРНК насчитывают около 21 нуклеотида (основания), иногда они могут быть чуть длиннее или короче, и большинство из них выступают, как представляется, в роли посттранскрипционных регуляторов экспрессии генов. Они не останавливают продукцию мРНК — вместо этого они регулируют ее «поведение». Обычно для этого они связываются с нетранслируемой областью 3’ (3’ НТР) молекулы мРНК. Эта область показана на рисунке 10.3. Она присутствует в зрелой мРНК, но не кодирует никакие аминокислоты.
Когда геномная ДНК копируется для продукции мРНК, оригинальный транскрипт обычно бывает очень длинным, поскольку он содержит в себе и экзоны (которые кодируют аминокислоты), и интроны (которые аминокислоты не кодируют). Как мы узнали из главы 3, интроны удаляются во время сплайсинга для продукции мРНК, кодирующей белок, но при описании этого процесса в главе 3 мы кое-что опустили. На РНК есть такие участки — в ее начале (называемый 5’ НТР) и в конце (3’ НТР), — которые не кодируют аминокислоты, но также и не сплайсируются, подобно интронам. Напротив, эти некодирующие области сохраняются на зрелой мРНК и действуют как регуляторные последовательности. Одна из функций 3’ НТР, в частности, состоит в том, чтобы связывать регуляторные молекулы, включая миРНК.
Как миРНК связывается с мРНК, и что происходит после этого? миРНК и 3’ НТР мРНК взаимодействуют только в том случае, если узнают друг друга. Для этого они пользуются спариванием оснований, довольно подобным тому, что мы встречали на двойных цепочках ДНК. Г может связаться с Ц, А может связаться с У (место Т в РНК занимает У). Хотя длина миРНК обычно составляет 21 основание, совсем не обязательно весь ее набор из 21 нуклеотида должен соответствовать мРНК. Ключевая область на миРНК занимает положение от 2 до 8.
Иногда соответствие на позициях от 2 до 8 оказывается не идеальным, но достаточно близким для того, чтобы две молекулы образовали пару. В таких случаях связывание миРНК препятствует трансляции мРНК в белок (именно это и произошло в ситуации, показанной на рис. 10.3). Если же соответствие полное, связывание миРНК с мРНК инициирует разрушение мРНК ферментами, прикрепленными к миРНК [140]. Пока нам еще не ясно, влияют ли позиции с 9 по 21 на миРНК менее непосредственным образом на то, как эти маленькие молекулы определяют свои мишени и к чему оно приводит. Однако мы знаем совершенно точно, что единственная миРНК может регулировать более чем одну молекулу мРНК. Из Главы 3 мы узнали, что один ген способен кодировать множество различных молекул белка, меняя способы сплайсирования матричной РНК. Единственная миРНК может одновременно оказывать влияние на многие из этих по-разному сплайсированных версий. Кроме того, единственная миРНК способна влиять и на совершенно неродственные белки, закодированные разными генами, но имеющие похожие последовательности 3’ НТР.
Все это существенно усложняет точное определение истинной роли миРНК в клетке, так как результаты ее деятельности варьируются в широких пределах в зависимости от типа клетки и других генов (кодирующих и не кодирующих белок), которые экспрессирует клетка в каждый момент времени. Проникновение в эти тайны имеет не только огромное экспериментальное значение, но и важные последствия для понимания природы самых разных заболеваний. Например, в ситуациях, присутствует аномальное число хромосом, меняется не только количество кодирующих белок генов. Здесь наблюдается и аномальная продукция нкРНК (длинных и коротких). Так как миРНК, в частности, способна регулировать множество других генов, то последствия нарушений в количестве копий миРНК могут быть очень разнообразными.
Пространство для маневра
Тот факт, что 98 процентов человеческого генома не кодирует белки, заставляет предположить, что эволюция приложила колоссальные силы для разработки сложных регуляторных процессов, протекающих с помощью нкРНК. Некоторые авторы заходят настолько далеко, что выдвигают гипотезы о том, что именно нкРНК являются генетическими факторами, предопределившими появление и развитие главной отличительных характеристик Homo sapiens — наших высших мыслительных процессов [141].
Геном шимпанзе, наших ближайших родственников, был описан в 2005 году [142]. Не существует какой-либо единственной и универсальной цифры, которую мы могли бы привести, чтобы продемонстрировать, насколько близки геномы шимпанзе и человека. Обобщить статистические данные невероятно сложно, потому что необходимо принимать во внимание различные области генома (например, повторяющиеся участки и единственная копия кодирующего белок гена), которые по-разному влияют на статистические показатели. Однако есть два фактора, в которых мы можем быть совершенно уверены. Первый из них заключается в том, что белки человека и шимпанзе удивительно похожи. Около трети всех белков абсолютно одинаковы у нас и наших длинноруких собратьев, а остальные отличаются лишь одной или двумя аминокислотами. Вторая наша общая отличительная черта состоит в том, что свыше 98 процентов наших геномов не кодируют белки. Это говорит о том, что оба вида используют нкРНК для создания сложных регуляторных сетей, которые управляют экспрессией гена и белка. Но между людьми и шимпанзе есть и существенное отличие, которое может иметь очень большое значение. Заключается оно в том, как обходятся с нкРНК клетки человека и шимпанзе.
Жалоба
Напишите нам, и мы в срочном порядке примем меры.





Комментарии