Биология: Обмен веществ и энергии в клетках организма - Рената Петросова Страница 3
Биология: Обмен веществ и энергии в клетках организма - Рената Петросова читать онлайн бесплатно
Гетеротрофы усваивают только готовые органические вещества, получая энергию при их расщеплении. Автотрофные и гетеротрофные организмы связаны между собой процессами обмена веществ и энергией. Фотосинтез является практически единственным процессом, обеспечивающим организмы питательными веществами и кислородом.
Несмотря на огромные масштабы фотосинтеза, зеленые растения Земли используют всего 1 % солнечной энергии, падающей на листья.
В последние годы особое внимание привлекает к себе одноклеточная водоросль хлорелла, которая содержит до 6 % хлорофилла и обладает замечательной способностью усваивать до 20 % солнечной энергии. При искусственном разведении хлорелла быстро размножается, а в ее клетке повышается содержание белка. Этот белок используется в качестве пищевых добавок ко многим продуктам. Установлено, что с 1 га водной поверхности можно получать ежедневно до 700 кг сухого вещества хлореллы. Кроме того, в хлорелле синтезируется большое количество витаминов.
Большой интерес ученых к хлорелле связан и с космическими полетами. Хлорелла в искусственных условиях может обеспечить кислородом, выделяемым при фотосинтезе, космический корабль.
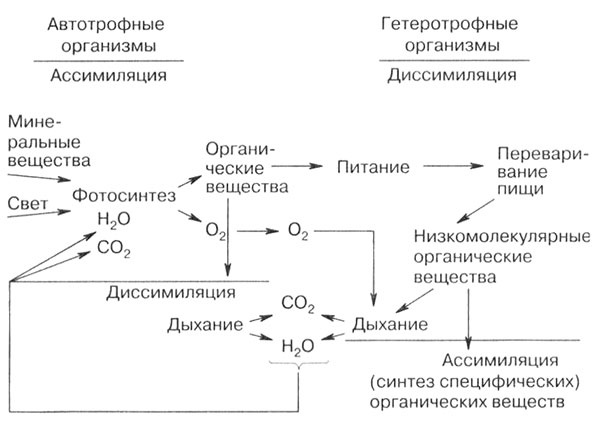
Рис. 4. Биологический круговорот веществ. Связь организмов и процессов обмена веществ
1. Какие две группы реакций составляют обмен веществ?
2. Охарактеризуйте процессы пластического и энергетического обмена.
3. За счет какой энергии идет синтез молекулы АТФ?
4. Назовите основной источник энергии на Земле. Как аккумулируется эта энергия?
5. Почему АТФ можно назвать ключевым источником энергии в реакциях обмена веществ?
6. Каково основное значение дыхания?
7. Какие типы обмена веществ по характеру используемой энергии и источнику получения углерода для синтеза органических веществ существуют на Земле?
8. Почему фотосинтез можно назвать основным процессом, обеспечивающим жизнь на Земле?
9. Чем отличается первичный синтез органических веществ от вторичного?
10. В чем отличие анаэробных и аэробных организмов?
Каждая клетка — животная, растительная, бактериальная, самая сложная или самая примитивная, характеризуется сложными химическими процессами. Важнейшей особенностью химических реакций, протекающих в клетке, является их каталитический характер. Биологическими катализаторами являются специализированные белки — ферменты, или энзимы.
Сотни реакций обмена веществ, которые происходят в клетке, идут при непосредственном участии ферментов. Вещество, которое связывается с ферментом для проведения химической реакции, называется субстратом. Ферменты активизируют субстрат, делают его доступным для проведения реакции. Ускоряя химические реакции, эти вещества в реакциях не расходуются. Они не влияют также и на природу конечных продуктов.
Из-за высокой скорости реакции небольшое количество фермента может катализировать превращение большого количества вещества, так как освобождение фермента каждый раз идет очень быстро.
Сравним скорость действия неорганических катализаторов и ферментов. Для гидролиза белка до аминокислот в лабораторных условиях необходимо в течение 10–15 ч кипятить белок с 20 %-ным раствором соляной кислоты. Если же к белку при комнатной температуре добавить несколько капель фермента трипсина или химотрипсина, то гидролиз закончится за 60–80 мин. Сопоставим условия этих двух реакций. Фермент действует в мягких условиях, а его скорость во много раз превышает скорость неорганических катализаторов.
Одним из наиболее важных отличий ферментов от неорганических катализаторов является их высокая специфичность к субстрату. Особенностью биокатализаторов является способность ускорять реакцию только с определенным субстратом или группой сходных по строению субстратов. Немецкий ученый Э. Фишер, исследуя эту удивительную избирательность ферментов, высказал предположение о наличии в их молекуле некоторого участка, структура которого строго соответствует структуре субстрата. Его выражение: «субстрат подходит к ферменту, как ключ к замку» — определило одно из самых важных свойств ферментов — специфичность по отношению к субстрату.
Например, в организме животных и человека отсутствует фермент, расщепляющий целлюлозу, но крахмал и гликоген легко подвергаются гидролизу ферментом амилазой. Разница в строении этих углеводов состоит только в том, что молекула первого вещества состоит из остатков β-глюкозы, а молекулы двух других — из остатков а-глюкозы. Фермент амилаза действует на α-гликозидную связь в молекуле крахмала, гликогена, мальтозы, но не действует на β-гликозидную связь в целлюлозе.
Фермент трипсин расщепляет как природный белок, так и искусственный полипептид, так как действует на пептидную связь. Эти ферменты обладают групповой специфичностью, так как действуют на вещества с одинаковой связью.
Однако есть такие ферменты, которые катализируют реакцию только с одним-единственным веществом.
Каждый фермент имеет определенное строение. Как и у всех белков, оно зависит от его первичной структуры, которая определяет третичную и четвертичную структуры, т. е. форму глобулы и ее пространственную конфигурацию. Результаты исследований показали, что молекулы ферментов во много раз больше, чем молекулы веществ, которые они активируют в реакциях. Ферменты, как правило, являются глобулярными белками. Часто они образуют комплексы с небелковыми компонентами: металлами (цинком, железом, марганцем, медью и др.), низкомолекулярными органическими соединениями, витаминами. Например, в состав каталазы входит железо; витамин B3 (или PP) является компонентом окислительно-восстановительных ферментов; витамин В, входит в состав ферментов, отщепляющих углерод от молекул органических соединений.
Ферменты, как вещества белковой природы, имеют большую молекулярную массу, которая колеблется от нескольких тысяч до миллиона. Например, трипсин имеет молекулярную массу 40 000, а синтетаза высших жирных кислот (ВЖК), катализирующая синтез жирных кислот, относится к ферментам-гигантам с молекулярной массой более 1 000 000. Она состоит из целого конвейера белков, объединенных в одну суперструктуру. Как правило, для высокомолекулярных ферментов характерна четвертичная структура. Например, фермент каталаза, расщепляющий пероксид водорода, состоит из шести субъединиц.
В ферменте различают три центра: субстратный, активный и регуляторный (рис. 5). Непосредственно в реакции участвует лишь небольшая часть белковой молекулы, состоящая обычно от 3 до 15 остатков аминокислот. Это каталитический, или активный, центр фермента. Остальные аминокислоты белка определяют конфигурацию молекулы, связывают субстрат, присоединяют дополнительные ионы. Активный центр является главной частью фермента. Здесь происходит видоизменение субстрата, собственно реакция, образуются продукты или продукт. В некоторых случаях функции активного центра выполняет небелковый компонент, например витамин, который в этом случае связан с ферментом и составляет единое целое.
Жалоба
Напишите нам, и мы в срочном порядке примем меры.





Комментарии