Карнавал молекул - Михаил Левицкий Страница 3
Карнавал молекул - Михаил Левицкий читать онлайн бесплатно
Ознакомительный фрагмент
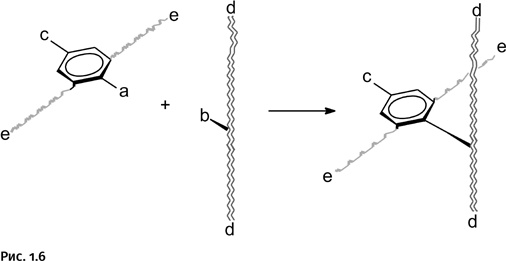
В полученном соединении группа c была заранее выбрана таким образом, чтобы на следующем этапе она могла реагировать одновременно с двумя группами d. Благодаря этому оба конца d стягиваются в одну точку, образуя первый цикл будущего катенана (рис. 1.7).
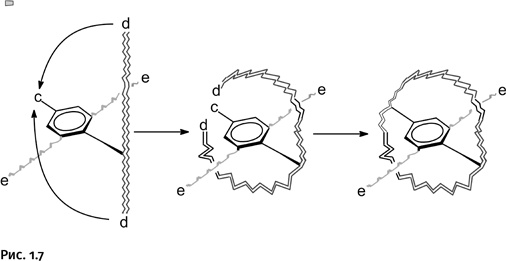
На следующем этапе происходит взаимодействие двух групп e, которые находятся на концах двух удлиненных цепей, присоединенных к бензольному кольцу (волнистые линии серого цвета). Ветви, на концах которых находятся группы е, имеют такую длину, чтобы реагирующие группы могли «дотянуться» друг до друга. В итоге образуется второе кольцо катенана (рис. 1.8).
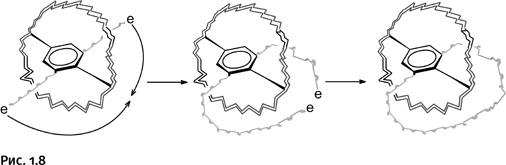
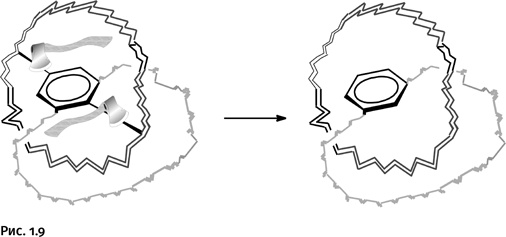
Однако полученные кольца не свободны, они соединены двумя перемычками (черные прямые линии с утолщением), которые следует удалить. Процесс удаления этих связей ниже показан условно с помощью двух рубящих топориков. В итоге получается катенан – два сплетенных кольца, химически не связанных друг с другом. В структуру одного из колец входит бензольное ядро как напоминание о «технологии строительства» этой необычной молекулы (рис. 1.9).
Мы рассмотрели лишь общую стратегию. Для того чтобы все получилось в реальности, необходимо было умело выбрать участвующие реагирующие группы. При этом потребовалось хорошее знание органической химии. Весь процесс синтеза, включая получение исходных веществ, состоит более чем из 20 стадий. По описанной схеме получено несколько катенанов. Ниже показана структура соединения, которое стало родоначальником этого класса, оно было синтезировано первым. Этот синтез Г. Шиллу и А. Люттрингхаусу удалось осуществить в 1964 г.
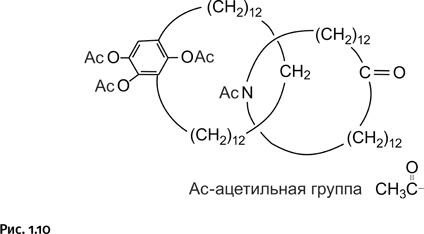
Основная часть колец набрана из 24 углеродных атомов (группы – СН2–), на котором постепенно собиралась вся эта необычная молекула (рис. 1.10).
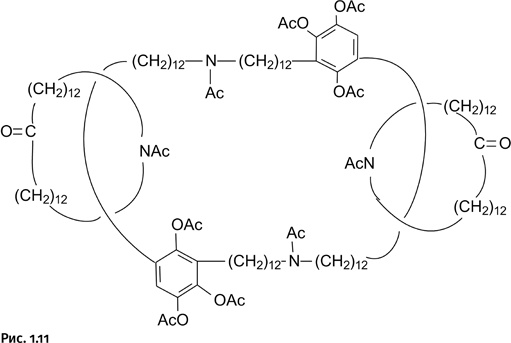
Ученые не остановились на достигнутом и по разработанной схеме получили более сложное соединение – три кольцевые молекулы, связанные по типу катенанов (рис. 1.11).
Ближайший родственник катенана
Практически одновременно с синтезом катенана Шиллу удалось осуществить получение еще одного соединения, названного ротаксаном (от лат. rotare – вращать). Это кольцевая молекула, насаженная на ось, снабженную на концах объемистыми заглушками. В результате кольцо может перемещаться по оси, вращаться, но не может «соскочить». Фактически это тоже соединение двух молекул не химическим, а чисто механическим способом.
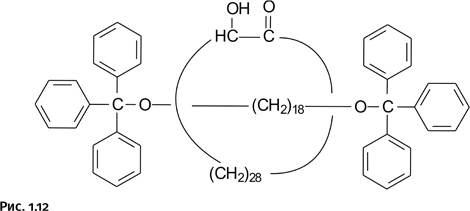
Сквозь кольцевую молекулу, составленную из 30 атомов углерода, продета линейная молекула гантелеобразной формы, роль концевых заглушек исполняют фенильные группы. Получение этого ротаксана проводили приблизительно по той же схеме, что и катенана (рис. 1.12).
Химию катенанов и ротаксанов принято рассматривать совместно, так как логика синтеза этих соединений почти одинакова. Итак, удалось показать, что такие молекулы получить можно. Далее большая армия химиков стала искать более совершенные способы синтеза, и они, разумеется, были найдены, причем такие, которые позволяли решать совершенно фантастические задачи. Сегодня исследование катенаноподобных молекул представляет собой самостоятельный, интенсивно развивающийся раздел химической науки.
Иной подход к решению задачи
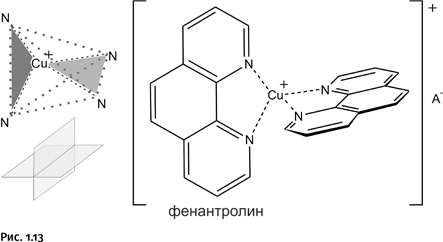
Самое главное при синтезе катенанов – расположить замыкающиеся кольца так, чтобы их плоскости были перпендикулярны: это облегчит замыкание одного цикла внутри другого. Но что может заставить их разместиться именно таким образом? В качестве «направляющего диспетчера» был использован катион меди Cu+, который легко образует комплекс с атомами азота двух молекул фенантролина. Связи, идущие от катиона меди (штриховые линии на рис. 1.13), направлены к вершинам мысленного тетраэдра (выделен точечными линиями), образуя две взаимоперпендикулярные плоскости (серые треугольники). Именно так располагаются около иона меди плоскости молекул фенантролина, играющих роль лигандов. Кстати, у катиона Cu+ обязательно имеется противоанион А– (например, Cl–), но при решении задачи мы не будем принимать его во внимание.
Далее, как показано на рисунке, следует две взаимоперпендикулярные молекулы фенантролина включить в состав циклов. Именно это и было проделано, только стратегия синтеза была несколько иной.
В качестве исходных соединений взяты две похожие молекулы, содержащие фрагмент фенантролина, но одна молекула – кольцевая, а вторая – незамкнутая (рис. 1.14).
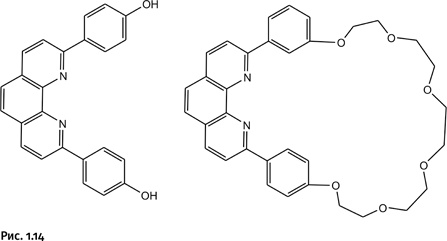
Далее к кольцевой молекуле добавили соединение, содержащее катион Cu+. Естественно, этот катион сразу образовал координационные связи с двумя атомами N (рис. 1.15).
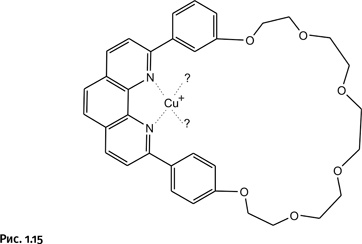
Однако катиону требуется в координационной сфере не два, а четыре атома N. Притянуть соседнюю такую же молекулу он не может, она громоздкая и не влезает внутрь первого кольца. Поэтому, когда введем в систему второй реагент, молекула которого не замкнута, катион Cu+, желая заполнить координационную сферу, втягивает второй реагент в кольцевую молекулу, как нитку в игольное ушко (для наглядности молекулы реагентов изображены линиями различной толщины). Именно этот хитроумный прием отсутствовал в методике, рассмотренной нами ранее. Катион Cu+, как уже было сказано, располагает фрагменты фенантролина взаимоперпендикулярно, что облегчает последующее замыкание второго кольца (рис. 1.16).
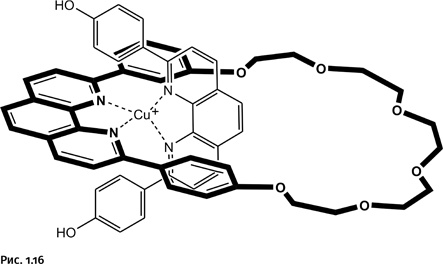
Осталось замкнуть второй цикл с помощью углеводородной цепочки, содержащей на концах атомы Cl, а затем удалить катион Cu+ (рис. 1.17).
Обратите внимание, синтез заранее продуман таким образом, чтобы состав переплетающихся колец был одинаков. Это не обязательное условие, но именно такой вариант придает дополнительное изящество полученному результату. Такой катенан сумел синтезировать в 1992 г. Ж. Саваж.
Жалоба
Напишите нам, и мы в срочном порядке примем меры.





Комментарии