Рождение сложности. Эволюционная биология сегодня. Неожиданные открытия и новые вопросы - Александр Марков Страница 11
Рождение сложности. Эволюционная биология сегодня. Неожиданные открытия и новые вопросы - Александр Марков читать онлайн бесплатно
Ознакомительный фрагмент
—————
Трансляция — синтез белка. Осуществляется особыми молекулярными «машинками» — рибосомами, которые состоят из нескольких больших молекул рибосомной РНК и большого числа менее крупных молекул рибосомных белков. Рибосомы синтезируют белок в соответствии с «инструкциями», записанными в молекуле матричной РНК (мРНК). Каждые три нуклеотида мРНК кодируют одну аминокислоту. Аминокислоты присоединяются к синтезируемой молекуле белка по одной. Доставка аминокислот к рибосомам осуществляется транспортными РНК (тРНК).
—————
Теория РНК-мира, вначале чисто умозрительная, очень быстро «обрастает» экспериментальными данными. Химики научились получать рибозимы чуть ли не с любыми желаемыми характеристиками. Делается это так. Например, мы хотим создать молекулу РНК, которая способна безошибочно узнавать вещество X и связываться с ним. Для этого синтезируют большое количество разных цепочек РНК, соединяя рибонуклеотиды друг с другом в случайном порядке. Раствор, содержащий полученную смесь молекул РНК, наливают на поверхность, покрытую веществом X. После этого остается лишь отобрать и исследовать те молекулы РНК, которые прилипли к поверхности. Технология незамысловата, но она действительно работает. Примерно таким способом получены рибозимы, катализирующие синтез нуклеотидов, присоединяющие аминокислоты к РНК и выполняющие множество других биохимических функций. Стирая грань между живым и неживым, уже растут на искусственных средах в лабораториях возмутительнейшие объекты — колонии размножающихся молекул РНК, способные к тому же синтезировать белки (правда, без этих самых белков — ферментов — заставить их расти пока не удается). Весомый вклад в эти исследования вносят ученые из Института химической биологии и фундаментальной медицины (г. Новосибирск) и Института белка (г. Пущино) под руководством академиков В. В. Власова и А. С. Спирина. Любопытно, что многие рибозимы работают лучше всего при низких температурах, иногда даже ниже точки замерзания воды — в крошечных полостях льда, где достигаются высокие концентрации реагентов. Некоторые считают это свидетельством того, что жизнь зарождалась при низких температурах.
Конечно, нельзя сказать, что в теории РНК-мира совсем нет проблем и трудностей. Их очень много. Основная, пожалуй, состоит в том, что большинство рибозимов очень малоэффективны по сравнению со своими белковыми аналогами. Во многих случаях это не принципиально, потому что на ранних этапах становления жизни белков еще не было, рибозимам не с кем было конкурировать, они на тот момент были «последним словом науки и техники». Их эффективности вполне хватало для того, чтобы предоставить химическим циклам, в которых они участвовали как катализаторы, решающее преимущество в скорости. Но некоторые ограничения могли оказаться принципиальными. В первую очередь это относится к вышеупомянутой способности рибозимов катализировать синтез собственных копий. В действительности тут все не так просто и гладко. В ныне живущих организмах таких рибозимов не обнаружено. Методом «искусственной эволюции» (то есть путем синтеза множества случайных последовательностей рибонуклеотидов, последующего отбора удачных вариантов, внесения в них небольших случайных изменений, нового отбора и т. д.) удалось получить рибозимы, которые худо-бедно могут «сшить» друг с другом два рибонуклеотида, но не всякие и не всегда. Осуществить полноценное копирование длинной молекулы РНК (то есть служить настоящими РНК-зависимыми РНК-полимеразами) они не могут. Чтобы изготовить из молекул РНК рибозим, который можно с полным правом назвать РНК-зависимой РНК-полимеразой, ученым пришлось воспользоваться наряду с «искусственной эволюцией» еще и сознательным, разумным планированием. В конце концов это удалось сделать — искомый рибозим был составлен из нескольких разных молекул РНК. Но даже и этот с таким трудом разработанный и изготовленный комплексный рибозим работает из рук вон плохо. В чем же дело?
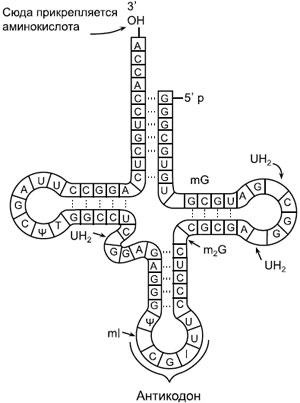
Схема транспортной РНК. A, G, C, U — стандартные нуклеотиды аденозин, гуанозин, цитидин и уридин, другими буквами отмечены нестандартные (модифицированные) нуклеотиды, в том числе I — инозин. Как и многие другие молекулы РНК, тРНК образует петли за счет того, что рибонуклеотиды попарно «склеиваются» друг с другом по принципу комплементарности. Как можно видеть на рисунке, C (цитозин) обычно склеивается с G (гуанином), а A (аденин) — с U (урацилом). Но в биологии, как мы уже знаем, нет правил без исключений: в двух местах этой молекулы, вопреки принципу комплементарности, G соединяется с U.
Не исключено, что дело тут в необходимых кофакторах — ионах металлов, в том числе редких. Известно, что очень многие белковые ферменты используют ионы металлов в качестве своих необходимых составных частей. Такие белки называют металлопротеинами. Похоже, это было справедливо и для рибозимов РНК-мира. До самого недавнего времени эту возможность упускали из виду. Однако недавно было обнаружено, что те самые искусственно полученные рибозимы, которые способны кое-как синтезировать РНК на РНКовой матрице, являются металлорибозимами: в их активном центре присутствует ион магния. Точно так же и проблему взаимодействия РНК с липидными мембранами удалось решить только благодаря объединению РНКовых комплексов с ионами металла, на этот раз — кальция.
Известно, что в древнем океане было гораздо больше, чем теперь, ионов различных тяжелых металлов, в том числе довольно экзотических, таких как вольфрам, молибден или ванадий [17]. Эти ионы до сих пор используются в качестве кофакторов многими белками, особенно у архаичных микроорганизмов. Может быть, дело у исследователей РНК-мира пойдет лучше, если они дадут рибозимам возможность «пользоваться услугами» ионов редких металлов?
—————
У микроба ферроплазмы почти все белки содержат железо. О важной и еще не до конца понятой роли металлов в жизни примитивных клеток свидетельствуют результаты изучения необычного микроба, обнаруженного в 2000 году в биореакторе металлургического завода в Туле.
Этот микроб, относящийся к надцарству архей (Archaea), получил название Ferroplasma acidiphilum. В отличие от большинства других архей и бактерий ферроплазма лишена жесткой клеточной стенки и размножается почкованием.
Ферроплазма живет в очень кислых водах, насыщенных растворенным железом и другими металлами. В природе такие условия встречаются в окрестностях месторождений сульфидных руд (например пирита). Ферроплазма сама производит органику из углекислого газа (подобно растениям), а питаться готовыми органическими веществами не может. В отличие от растений источником энергии для синтеза органики из CO2 ферроплазме служит не солнечный свет, а химическая реакция окисления двухвалентного железа (Fe2+=>Fe3+).
Жалоба
Напишите нам, и мы в срочном порядке примем меры.





Комментарии