Самая главная молекула. От структуры ДНК к биомедицине XXI века - Максим Франк-Каменецкий Страница 11
Самая главная молекула. От структуры ДНК к биомедицине XXI века - Максим Франк-Каменецкий читать онлайн бесплатно
Ознакомительный фрагмент
Все это в полной мере относится и к ДНК – с ростом температуры существование двойной спирали становится невыгодным. Межмолекулярные связи, Н-связи внутри пар оснований и так называемые стэкинг-взаимодействия между соседними вдоль цепи парами, удерживающие две комплементарные цепи друг около друга, рвутся, и из одной двунитевой молекулы образуется две однонитевые цепи (рис. 11). Энтропийно (т. е. в смысле получения большей свободы) это выгодно потому, что, не будучи связанной с комплементарным партнером, каждая цепь чувствует себя гораздо свободнее, может приобретать намного больше различных конфигураций в пространстве.
Сами нити ДНК порвать простым нагреванием нельзя – связи, соединяющие нуклеотиды в цепочку, настолько прочны, что их можно разрушить либо сильной кислотой, либо порезать ферментами нуклеазами.
Несмотря на аналогию, плавление ДНК принципиально отличается от плавления льда. Отличие состоит в том, что плавление ДНК происходит в широком интервале температур; этот интервал равен нескольким градусам, а плавление льда происходит строго в одной точке на шкале температур. Это так называемый фазовый переход. При таком переходе скачкообразно изменяется фазовое состояние вещества – из твердого оно становится жидким, из жидкого – газообразным.
Рис. 11. Так плавится ДНК
Мы каждый день сталкиваемся с фазовым переходом, когда кипятим чайник. В процессе кипения система вода—пар находится в самой точке фазового перехода – температура чайника ни на йоту не превысит 100 °C, пока не выкипит вся вода. То же самое будет происходить при нагревании льда или снега. Температура растет до 0 °C, потом рост прекратится, пока весь лед полностью не растает, а затем температура вновь пойдет вверх.
В отличие от фазовых систем, у ДНК температура растет непрерывно, и с ее повышением все новые участки молекул переходят из спирального состояния в расплавленное. Интересно, что это отличие – прямое следствие одномерности кристалла ДНК.
Осознавать, что такое поведение вещества возможно, физики начали еще до Второй мировой войны, когда и не думали о ДНК или о реальных одномерных кристаллах. Просто никак не удавалось построить полную теорию фазовых переходов в настоящих трехмерных кристаллах (это получилось лишь гораздо позже – в 1970-х годах), и возникла мысль, что, может быть, удастся это сделать хотя бы для одномерного или двумерного кристалла. Проанализировать первый вариант оказалось совсем просто. Но вот беда – никакого фазового перехода не получалось. Глубокий смысл этой неудачи был понят знаменитым советским физиком Львом Давидовичем Ландау (мы уже упоминали его имя в начале главы 2). Вот что он писал (вместе с Е. М. Лифшицем) в 1938 году: «Во всякой одномерной системе не может существовать фаз, так как они стремились бы перемешиваться друг с другом». Это утверждение, известное во всем мире как «теорема Ландау», долгое время считалось чисто негативным, означающим только, что одномерная система – никуда не годная модель для теоретического рассмотрения проблемы фазовых переходов.
Вряд ли Ландау думал, что когда-нибудь найдутся реальные системы, к которым удастся применить его утверждение. Но ДНК – это действительно почти такая система. Слово «почти» здесь поставлено потому, что теорема Ландау была доказана для строго однородных систем, а ДНК, как мы помним, – апериодический кристалл. Его составляют два сорта звеньев – пары А•Т и Г•Ц, отличающиеся силой связи. Пару А•Т легче порвать, чем пару Г•Ц. Поэтому ДНК, которая содержит больше пар А•Т, плавится при более низкой температуре.
Важно ли то, сколько типов пар – два или один, как в строго однородном кристалле? Да, важно. Это очень интересный вопрос, и его исследовали многие теоретики уже прямо в связи с проблемой плавления ДНК. Прежде всего следует отметить работы М. Азбеля, А. Веденова, А. Дыхне, Д. Крозерса, И. Лифшица, Э. Монтролла, Д. Поланда. Много занимался данной проблемой и автор этих строк.
Что же оказалось? Вывод, сделанный Л. Д. Ландау, остается в силе. И в апериодической ДНК фазового перехода быть не может. Принципиально это также объясняется одномерностью системы, но происходит по иной причине, чем в строго однородном кристалле. Фазы отсутствуют не потому, что они стремились бы перемешиваться, как говорил Ландау, а потому, что участки ДНК, обогащенные парами А•Т, плавятся при более низкой температуре, чем участки, обогащенные парами Г•Ц. Поэтому переход в новое состояние происходит с ростом температуры не скачком, а поэтапно, участок за участком.
Если мерить зависимость поглощения тепла от температуры для раствора молекул ДНК, то на графике, отражающем эту зависимость, вместо одного бесконечно узкого пика, который характерен для плавления льда, мы должны наблюдать множество пиков, отвечающих выплавлению отдельных участков в молекуле. Ширина каждого пика, как предсказывает теория, должна соответствовать примерно 0,5 °C. Эксперимент полностью подтвердил это предсказание. На рис. 12 видно, как идет поэтапное плавление ДНК (плазмиды Соl Е1), содержащей около 6500 пар оснований.
Конечно, никто не может измерить теплопоглощение одной-единственной молекулы. Экспериментатор обычно имеет дело с образцом, состоящим из миллиардов и миллиардов молекул, но у всех у них строго одинаковая последовательность нуклеотидов. И при той или иной температуре во всех молекулах раскрываются одни и те же участки. Поэтому, исследуя эффект на множестве одинаковых молекул, можно судить о том, что происходит с каждой из них в отдельности.
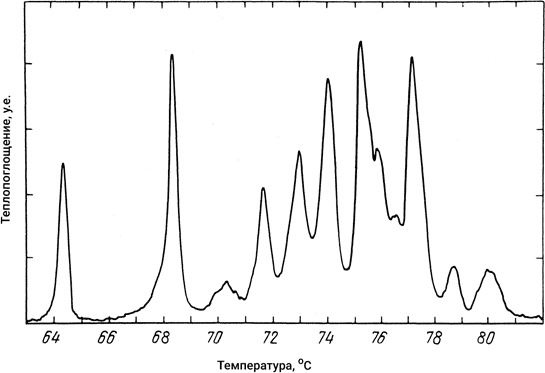
Рис. 12. Зависимость теплопоглощения ДНК от температуры. Такую кривую часто называют также дифференциальной кривой плавления. Приведенная кривая получена для ДНК, носящей кодовое название Соl Е1 и содержащей около 6500 пар нуклеотидов
Сотрудникам Института молекулярной генетики РАН в Москве (А. Боровик с соавторами) удалось буквально воочию наблюдать поэтапное плавление ДНК. Они научились фиксировать раскрытые участки в молекуле с помощью специально подобранного химического агента. Обработанные препараты изучались под электронным микроскопом. Опыт шел так. Раствор ДНК нагревали до определенной температуры, попадающей в интервал плавления. При этом раскрывались отдельные участки молекулы (цепи в этих местах расходились, и азотистые основания оказывались торчащими наружу). Затем в раствор добавляли вещество, реагирующее с раскрытыми основаниями, но неспособное связываться с основаниями, запрятанными внутри двойной спирали. Когда реакция заканчивалась, образец охлаждали до комнатной температуры – прореагировавшие участки уже не могли вновь закрыться и образовать двойную спираль.

Рис. 13. Так выглядит ДНК Соl Е1 под электронным микроскопом после того, как ее состояние зафиксировали при температуре 72 °C. Ясно видны три раскрытых, расплавленных участка: два – на концах и один – в середине
Жалоба
Напишите нам, и мы в срочном порядке примем меры.





Комментарии